Amoníaco
El amoníaco, amoniaco, azano, espíritu de Hartshorn o gas de amonioes un compuesto químico de nitrógeno con la fórmula química NH3. Es ungas incoloro con un característico olor repulsivo. El amoniaco contribuye significativamente a las necesidades nutricionales de los organismos terrestres por ser un precursor de comida y fertilizante. El amoniaco directa o indirectamente, es también un elemento importante para la síntesis de muchos fármacos y también es usado en diversos productos comerciales de limpieza. Pese a su gran uso, el amoniaco es cáustico y peligroso. La producción industrial del amoniaco del 2012 fue de 198 000 000 toneladas, lo que equivale a un 35 % de incremento con respecto al año 2006, con 146 500 000 toneladas.
Aparición natural
El amoniaco es encontrado en pequeñas cantidades en la atmósfera, siendo producido por la putrefacción de la materia nitrogenada proveniente de plantas y animales. El amoniaco y sales de amonio también se encuentran en pequeñas cantidades en el agua de lluvia, donde el cloruro de amonio y sulfato de amonio se encuentran en zonas volcánicas; los cristales de bicarbonato de amonio se han encontrado en la Patagonia, guano. El riñón secreta amoniaco para neutralizar el exceso de ácido.6 Las sales de amoniaco se encuentran distribuidas a través de suelo fértil y en el océano. El amoniaco también se encuentra a través del sistema solar en Marte, Júpiter, Saturno, Urano, Neptuno y Plutón. Las sustancias que contienen amoniaco, o aquellas que son similar a él, se llaman amoniacales.
Propiedades
El amoniaco es un gas incoloro con un olor desagradable. Es más ligero que el aire, su densidad es 0.589 veces la del aire de la atmósfera. Es fácilmente condensado por sus fuertes puentes de hidrógeno entre las moléculas; el líquido hierve a -33.3 °C y se congela a los -77.7 °C en cristales blancos.7
El amoniaco se puede desodorizar fácilmente reaccionando con bicarbonato de sodio o ácido acético. Ambas reacciones forman sales de amoniaco sin olor.Sólido
La simetría del cristal es cúbico, su símbolo pearson es CP16, grupo espacial P213 No.198, constante de red 0.5125 nm.8Líquido
El amoniaco líquido posee fuertes fuerzas ionizantes reflejando su alta constante dieléctrica de 22. El amoniaco líquido tiene una muy alta entalpía de vaporización (23.35 kJ/mol, cf. agua 40.65 kJ/mol, metano 8.19 kJ/mol, fosfina 14.6 kJ/mol) y puede ser usado en laboratorios en vasos no aislados sin refrigeración.Propiedades disolventes
El amoniaco es miscible con agua. En una solución acuosa, puede salir con ebullición. La solución acuosa de amoniaco es una base. La concentración máxima de amoniaco en agua tiene una densidad de 0.880 g/cm3 (880 kg/m3) y es frecuentemente sabido como 'amoniaco 0.880'. El amoniaco no se quema ni sostiene combustión, excepto bajo estrechas mezclas de combustible de 15 a 25 % de aire.Combustión
Cuando se mezcla con oxígeno, se quema con una llama de color verde amarillento pálido. A una alta temperatura y en la presencia de un catalizador, el amoniaco se descompone en sus elementos constituyentes. La combustión ocurre cuando la clorina pasa a amonio, formando nitrógeno y cloruro de hidrógeno; si la clorina esta en exceso, se forma el explosivo tricloruro de nitrógeno (NCl3).
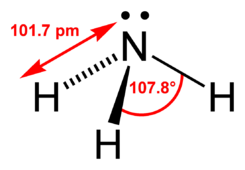
La molécula de amoniaco tiene una forma trigonal piramidal, como lo predice la teoría de repulsión de los pares de electrones de la capa de valencia, con un ángulo de enlace determinado de 106.7º.9 El átomo central de nitrógeno tiene cinco electrones externos con un electrón adicional de cada átomo de hidrógeno. Esto da un total de ocho electrones, o cuatro pares de electrones que son acomodan tetraédricamente. Tres de esos pares de electrones se usan como enlaces pares, lo que deja un par de electrones libres. Este par repele más fuertemente los pares de enlaces, entonces el ángulo del enlace no es de 109.5º como se esperaría por un acomodo tetraedral, sino de 106.7º.9 El átomo de nitrógeno en la molécula tiene un par de electrones libres, lo cual provoca que el amoníaco sea una base, aceptador de protones. Esta forma le da a la molécula un momento dipolo y lo hace una molécula polar. La polaridad de la molécula y, especialmente, su habilidad para formar puentes de hidrógeno, hace que el amoníaco sea altamente miscible en agua. El amoníaco es moderadamente básico, una solución acuosa a 1 M tiene un pH de 11.6 y si un ácido fuerte es agregado a la solución hasta que la solución alcance un pH neutral (pH=7), 99.4 % de las moléculas amoníaco se protonan. La temperatura y la salinidad también afectan la proporción de NH4+. Lo resultante tiene una forma regular y es isoelectrónico con metano.
La molécula de amoniaco fácilmente experimenta inversión del nitrógeno a temperatura ambiente; una analogía útil es que cuando una sombrilla gira al revés en un fuerte viento. La barrera de energía a esta inversión es de 24.7 kJ/mol, y la frecuencia resonante es de 23.79 Hz, correspondiente a la radiación de un microondas con una longitud de onda de 1.260 cm. La absorción a esta frecuencia fue la primera espectroscopia de microondas observada.